Die Lichtmikroskopie hat sich in den letzten Jahrzehnten als unverzichtbares Instrument in den Lebenswissenschaften und den Materialwissenschaften etabliert. Ihre Stärke liegt in der Möglichkeit, eine dreidimensionale Darstellung aus dem Inneren von hinreichend transparenten Proben zu gewinnen. Die konventionelle Lichtmikroskopie leidet unter der Einschränkung, dass ihre Auflösung aufgrund der Wellennatur des Lichts auf 200-300 nm begrenzt ist. Damit bleiben wichtige Größenskalen wie z. B. die Skala einzelner Moleküle verschlossen.
Die hochauflösende Fluoreszenzmikroskopie umgeht diese Limitierung und bedient sich hierzu eines Tricks. Die Eigenschaften fluoreszierender Markermoleküle werden derart ausgenutzt, dass die Informationen, die sich innerhalb des Bereichs eines verwaschenen Lichtflecks befinden, sequentiell ausgelesen werden können.
Innerhalb der Lebenswissenschaften hilft die optische Nanoskopie beim Erkennen von Strukturen und Funktionen in lebenden Zellen. Damit eröffnen sich einmalige Möglichkeiten zum Verständnis der dort ablaufenden molekularen Prozesse.
Dieser Erkenntnisgewinn ist einer der Schlüssel für das Verständnis von Krankheiten und damit für die Entwicklung von diagnostischen Verfahren, neuen Medikamenten und für deren therapeutischen Einsatz.
Im technischen Bereich liegen Anwendungsgebiete in der Simulation von Atom- und Molekülsystemen mit Hilfe von Kolloidsystemen oder der Untersuchung der Selbstorganisation von Nanostrukturen. Die Größe der verwendeten Kolloide ist nicht mehr durch das Beugungslimit beschränkt und steht somit als wichtiger Kontrollparameter zur Verfügung. Weiterhin können die grundlegenden Prinzipien der Nanoskopie nicht nur zum Beobachten, sondern auch zum Verändern einer Probe eingesetzt werden, zum Beispiel im Bereich der Lithographie von kleinen Strukturen unterhalb der Beugungsgrenze für die Herstellung von Computerchips.
Die im dritten Quartal des Jahres 2010 gegründete Abteilung „Optische Nanoskopie“ widmet sich der anwendungsorientierten Grundlagenforschung im Rahmen der „Fluoreszenzmikroskopie unterhalb der Beugungsgrenze“ und erweitert deren Methodenspektrum. Hierbei liegt der Schwerpunkt auf zwei komplementären Verfahren der hochaufgelösten Fluoreszenzmikroskopie im Fernfeld:
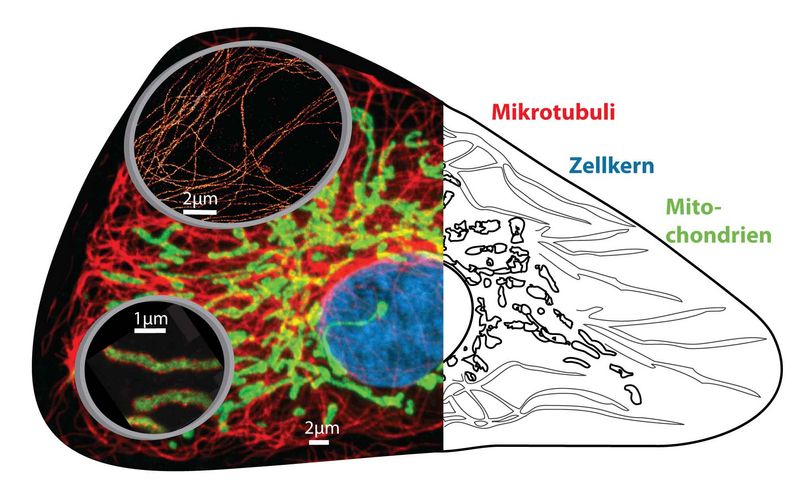
Collage zur optischen Nanoskopie in Zellen. Konventionelle beugungslimitierte fluoreszenz-mikroskopische Aufnahme (links im Hintergrund) und Schemazeichnung (rechts) von Zellorganellen. Lupen (links, Vordergrund) zeigen nanoskopische Aufnahmen von Mikrotubuli (oben) und Mitochondrien (unten) mit Aufösungen im Bereich von nur einigen 10 Nanometern
Ein weiterer Forschungsschwerpunkt der Abteilung ist die Bildgebung lebender Zellen mittels Biolumineszenz. In diesem Prozess, der in der Natur beispielsweise in Glühwürmchen zu finden ist, wird Licht durch eine biochemische Reaktion von den Zellen selbst erzeugt und kann direkt zur Bildgebung genutzt werden. Anders als bei fluoreszenzbasierten Verfahren wird hierfür kein Anregungslicht benötigt, sodass die Bildgebung auch über lange Zeiträume hinweg auf schonende Weise durchgeführt werden kann, ohne die Markermoleküle und Zellen durch externes Licht zu beeinflussen.
Von besonderer Bedeutung ist die Biolumineszenz-Bildgebung ohne Zugabe chemischer Substrate, welche in der Regel zur Lichterzeugung erforderlich sind. Zu diesem Zweck nutzen wir das bakterielle Biolumineszenz-System, das neben Bakterien auch in anderen Zelltypen wie z.B. menschlichen Zellen eingesetzt werden kann. Die Intensität des Biolumineszenzlichts liefert zusätzlich Informationen über die Vitalität der Zellen und kann daher verwendet werden, um die Effekte von zellschädigenden Stoffen oder die Wirkung bestimmter Arzneimittel zu untersuchen.
Zur Biolumineszenz-Bildgebung auf verschiedenen Größenskalen werden unterschiedliche Messsysteme entwickelt und eingesetzt. Hierzu zählen kamera- und faserbasierte Systeme zur Aufnahme makroskopischer Proben sowie ein Mikroskop zur Abbildung einzelner Zellen.
STED-Mikroskopie
Der Schlüssel zur Umgehung der Beugungsgrenze mit freipropagierenden Lichtstrahlen liegt darin, die Eigenschaften der Markermoleküle derart auszunutzen, dass sie von einem hellen, also detektierbaren Zustand in einen dunklen, also nicht detektierbaren Zustand oder umgekehrt überführt werden.
Dies geschieht in einer solchen Art und Weise, dass der Bereich, innerhalb dessen die Markermoleküle im hellen Zustand sind, räumlich eingeschränkt wird.
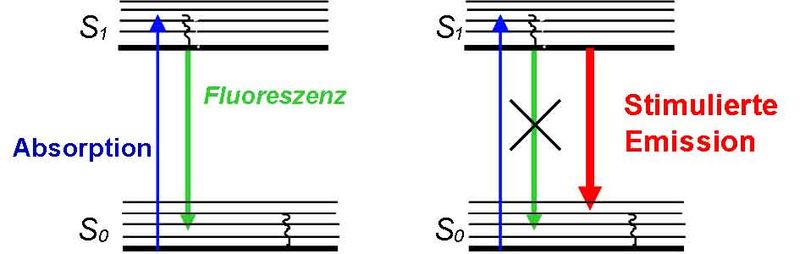
Das STED (Stimulated Emission Depletion, stimulierte Fluoreszenzlöschung)-Prinzip verwendet den Prozess der stimulierten Emission, um Fluoreszenzmarker vom hellen angeregten elektronischen Zustand S1 in den dunklen elektronischen Grundzustand S0 zu überführen.
Um den Bereich, in dem Marker fluoreszieren können, jenseits des Beugungslimits zu verkleinern, werden ein beugungslimitierter Anregungsfokus und ein donut-förmiger STED-Fokus überlagert. Mit dem Ersten wird ein Ensemble von Markermolekülen angeregt, mit dem Zweiten werden die Moleküle über den Prozess der stimulierten Emission so schnell wieder „ausgeschaltet“, dass sie kein Fluoreszenzphoton emittieren können.
Nur in der Mitte des STED-Donuts, an der die STED-Intensität Null ist, können die Moleküle noch fluoreszieren.
Zur Bilderstellung wird dieser fluoreszierende Spot, dessen Ausdehnung von der Intensität des STED-Strahls abhängt und theoretisch beliebig verkleinert werden kann, über die Probe gerastert.
isoSTED-Mikroskopie
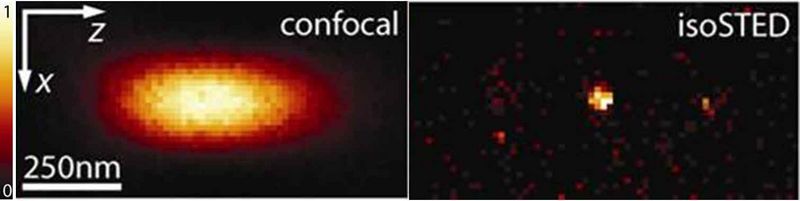
Die isoSTED-Mikroskopie ist eine geschickte Kombination aus STED- und 4Pi-Mikroskopie und verkleinert den konfokalen (zigarrenförmigen) Lichtfokus auf eine Kugel von nur 30 nm Durchmesser. Dies entspricht einer Reduzierung des fokalen Volumens um drei Größenordnungen [Schmidt et al., 2009].
Die gleichzeitige kohärente Verwendung von zwei sich gegenüberstehenden Objektiven (4Pi-Konfiguration) ermöglicht hierbei die nahezu isotrope Auflösung in allen drei Raumrichtungen.
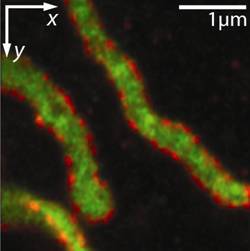
Mit diesem „3D-Nanoskop“ war es erstmals möglich, das Innere von Mitochondrien (den Kraftwerken der Zelle) in intakten Zellen mit dem Lichtmikroskop aufzulösen [Schmidt et al., 2008].
So konnte in ungekannter Schärfe die Verteilung von zwei Proteinen, von denen das eine Cluster in der Mitochondrienmembran bildet, während das andere im Inneren zu finden ist, abgebildet werden.
Weiterführende Informationen
STED-Mikroskopie
- Internetseite der Abteilung NanoBiophotonik am MPI für biophysikalische Chemie: http://www.nanoscopy.de
- S. W. Hell (2007):
„Nanoskopie mit fokussiertem Licht“
Physik Journal 6 (12), 47 – 53 - S. W. Hell (2008):
„Microscopy and its focal switch“
Nature Meth. 6 (1), 24 – 32, Perspective, Special Feature, see Method of the year 2008 - S. W. Hell (2009):
„Far-Field Optical Nanoscopy“
In: Single Molecule Spectroscopy in Chemistry, Physics and Biology. Springer (Berlin, Germany), 365 – 398
isoSTED-Mikroskopie
- R. Schmidt, C. A. Wurm, S. Jakobs, J. Engelhardt, A. Egner, S. W. Hell (2008):
„Spherical nanosized focal spot unravels the interior of cells“
Nature Meth. 5 (6), 539 – 544 - R. Schmidt, C. A. Wurm, A. Punge, A. Egner, S. Jakobs, S. W. Hell (2009):
„Mitochondrial Cristae Revealed with Focused Light“
Nano Lett. 9 (6), 2508-2510 - S. W. Hell, R. Schmidt, A. Egner (2009):
„Diffraction-unlimited three-dimensional optical nanoscopy with opposing lenses“
Nature Photonics 3, 381 – 387
SMS-Mikroskopie
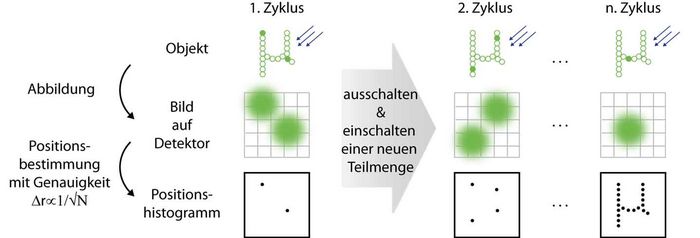
Die hochauflösende Fluoreszenzmikroskopie nutzt die spektralen Eigenschaften von Markermolekülen aus, um das Beugungslimit zu umgehen. Im Gegensatz zum ensemblebasierten Ansatz (wie z. B. bei der STED-Mikroskopie) geschieht dies bei der SMS (Single Marker Switching)-Mikroskopie auf Einzelmolekülbasis. Einzelne Marker werden zufällig aus einer Vielzahl von Molekülen, die sich in einem dunklen Zustand befinden, herausgegriffen und in einen hellen, also einen detektierbaren, Zustand überführt. Aus dem beugungslimitierten Fluoreszenzbild dieses einzelnen Moleküls, das räumlich und zeitlich von den Fluoreszenzbildern anderer Moleküle getrennt ist, lässt sich seine Position bestimmen. Die Lokalisationsgenauigkeit ist hierbei besser als das Beugungslimit und skaliert mit √N, wobei N die Anzahl der detektierten Photonen ist.
Nachdem das Molekül wieder in einen dunklen Zustand überführt wurde, wird dieser Prozess des Anschaltens, Auslesens und Ausschaltens von stochastisch ausgewählten Markern hinreichend oft wiederholt; das Histogramm aller bestimmten Markerpositionen ergibt dann das hochaufgelöste SMS-Bild.
Prinzip der SMS-Mikroskopie. Links: Nur wenige Marker in der Probe sind im hellen Zustand, so dass ihre beugungslimitierten Bilder auf dem Detektor nicht überlappen. Die lokalisierten Positionen werden in ein Histogramm eingetragen. Mitte: Nachdem die im ersten Zyklus ausgelesenen Marker ausgeschaltet wurden, werden neue angeschaltet und lokalisiert. Rechts: Dies wird wiederholt, bis ausreichend viele Markerpositionen registriert sind, um das Objekt zu rekonstruieren
4Pi-SMS-Mikroskopie
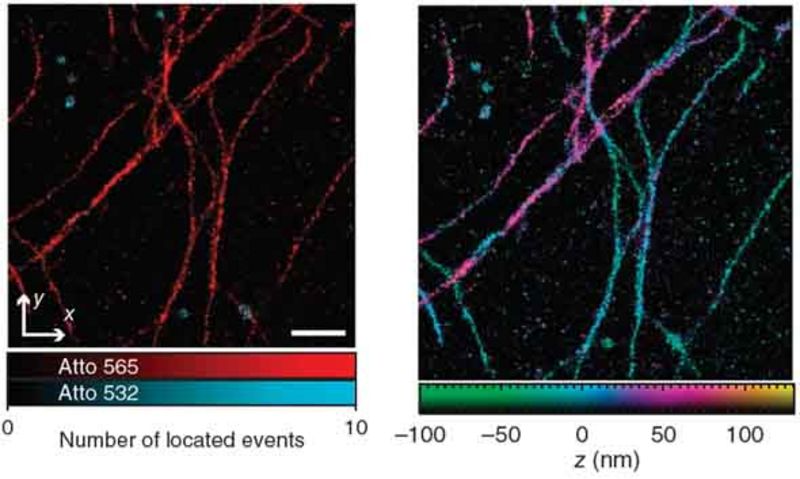
Ein SMS-Bild ergibt sich im einfachsten Fall aus dem Histogramm von hinreichend vielen Markerpositionen, wobei jede einzelne Position aus dem beugungslimitierten Fluoreszenzbild eines einzelnen Emitters berechnet wird. Bei der dreidimensionalen Lokalisation stellt insbesondere die axiale Lokalisierung eine Herausforderung dar. Das 4Pi-SMS-Mikroskop meistert diese, indem es zur Fluoreszenzdetektion zwei gegenüberliegende Objektive kohärent verwendet [Aquino et al., 2011]. Eine Analyse von mindestens drei, mit unterschiedlicher relativer Phase erzeugten, Interferenzbildern pro Marker ermöglicht seine axiale Lokalisation mit sehr hoher Genauigkeit.
Das 4Pi-SMS-Mikroskop erlaubt eine Lokalisation besser als 10 nm in allen drei Raumrichtungen und dies über einen ausgedehnten axialen Bereich von ca. 650 nm. Zusätzlich bietet es die Möglichkeit, unterschiedliche Spezies von Markermolekülen, z. B. spektral, zu unterscheiden.
Weiterführende Informationen
SMS-Mikroskopie
- S. W. Hell:
„Microscopy and its focal switch“
Nature Meth. 6 (1), 24 – 32, Perspective, Special Feature, See Method of the year 2008 - A. Egner, C. Geisler, C. von Middendorff, H. Bock, D. Wenzel, R. Medda, M. Andresen, A. C. Stiel, S. Jakobs, C. Eggeling, A. Schönle, S. W. Hell:
„Fluorescence nanoscopy in whole cells by asynchronous localization of photoswitching emitters“
Biophys. J. 93, 3285 – 3290, 2007 - C. Geisler, A. Schönle, C. von Middendorf, H. Bock, C. Eggeling, A. Egner, S. W. Hell:
„Resolution of Lambda /10 in fluorescence microscopy using fast single molecule photo-switching“
4Pi-SMS-Mikroskopie
- D. Aquino, A. Schönle, C. Geisler, C. v. Middendorff, C. A. Wurm, Y. Okamura, T. Lang, S. W. Hell, A. Egner:
„Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores“, Nature Methods, 8 (4), 353 – 359, 2011 - S. W. Hell, A. Egner:
„Diffraction-unlimited three-dimensional optical nanoscopy with opposing lenses“, Nature Photonics 3, 381 – 387, 2009 - C. v. Middendorff, A. Egner, C. Geisler, S. W. Hell, A. Schönle:
„Isotropic 3D Nanoscopy based on single emitter switching“
Opt. Expr. 16 (25), 20774-20788, 2008
Biolumineszenz-Bildgebung
Das Biolumineszenzlicht wird in der Zelle durch die Oxidation eines organischen Moleküls (das Luciferin) erzeugt. Hierbei entsteht ein Produkt in einem elektronisch angeregten Zustand, welches anschließend ein Photon aussendet. Diese Reaktion wird durch ein Enzym (die Luciferase) katalysiert.
Das emittierte Licht kann mit Hilfe einer Kamera aufgenommen werden, um ein Bild der Probe zu erhalten. Während die Luciferase von der Zelle hergestellt wird, wird das Luciferin, das bei der Reaktion verbraucht wird, in der Regel von außen zugegeben.
Bakterielles Biolumineszenz-System
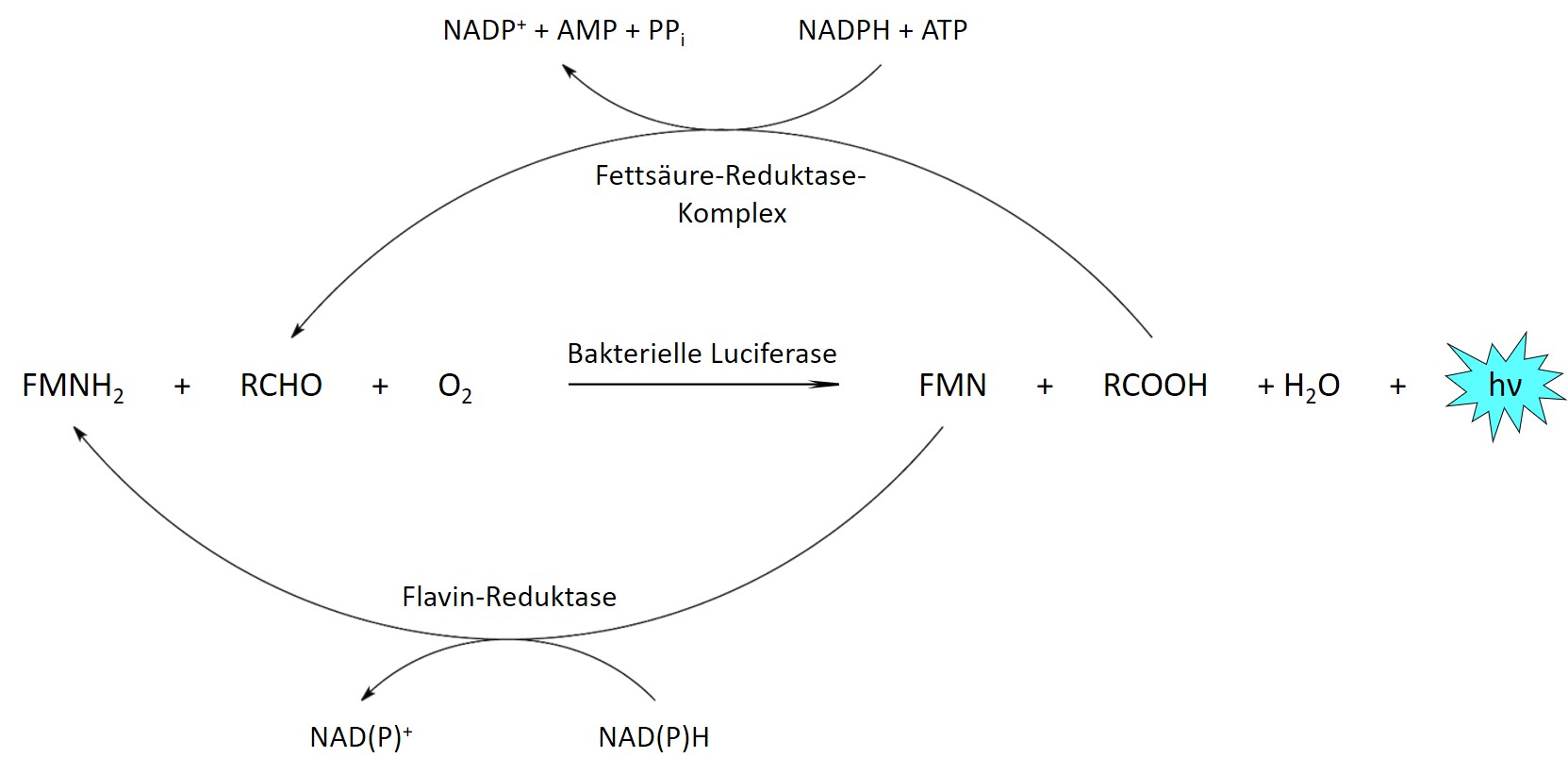
Um eine kontinuierliche Lichtemission über lange Zeiträume aufrecht zu erhalten, kann das Luciferin stattdessen von den Zellen selbst produziert werden. Hierfür sind weitere Enzyme erforderlich, die bei den meisten Biolumineszenz-Systemen jedoch bisher nicht vollständig bekannt sind, sodass eine Übertragung der entsprechenden Stoffwechselwege in andere Zelltypen bzw. Organismen nicht möglich ist. Eine Ausnahme stellt das System aus biolumineszierenden Bakterien dar, welches neben der bakteriellen Luciferase mehrere Enzyme für die Herstellung der beiden Substrate aus gewöhnlichen Zellmetaboliten umfasst.
Bakterielle Biolumineszenzreaktion. Reduziertes FMN (FMNH2) und ein langkettiger Aldehyd (RCHO) werden von der Luciferase durch Sauerstoff oxidiert. Die beiden Produkte werden vom Fettsäure-Reduktase-Komplex und einer Flavin-Reduktase unter Verbrauch zellulärer Energie in ihre reduzierte Form zurückverwandelt.
Biolumineszenz in Bakterien
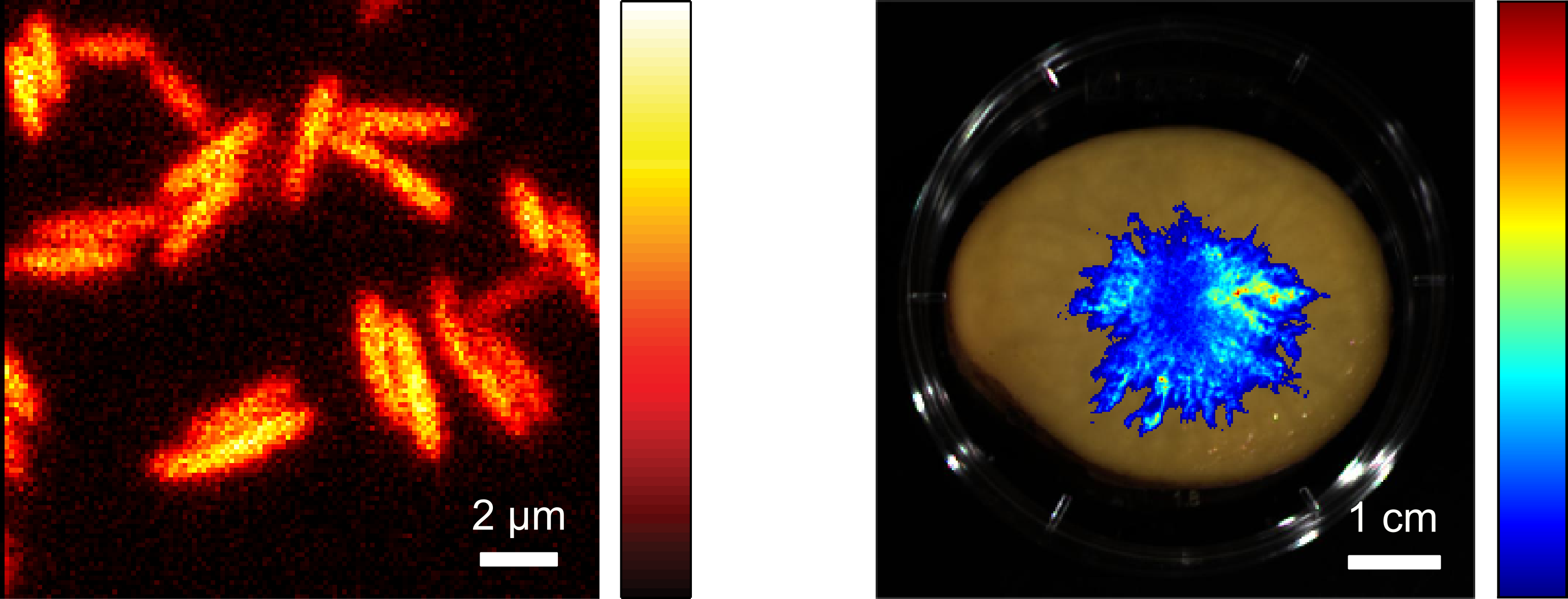
Die entsprechenden Enzyme aus biolumineszierenden Bakterien können in andere Bakterien eingebracht werden, wo sie ebenfalls Licht produzieren und zur zellulären Bildgebung verwendet werden können. Da die Helligkeit vergleichsweise gering ist, wurden verbesserte Varianten der Enzyme erzeugt, welche eine deutliche Steigerung der Lichtemission in Bakterien wie Escherichia coli bewirken.
Dies ermöglicht die Beobachtung einzelner Zellen durch Biolumineszenz-Mikroskopie. Daneben können auch Bakterien in großen Probenbereichen abgebildet werden, beispielsweise um ihr Wachstum und ihre Ausbreitung in Lebensmitteln zeitlich zu verfolgen.
Biolumineszenz in Säugerzelllinien
Die Enzyme des bakteriellen Biolumineszenz-Systems können neben Bakterien auch in andere Zelltypen wie zum Beispiel menschliche Zellen eingebracht werden und ermöglichen auch hier eine Lichterzeugung ohne die Zugabe externer Substrate. Durch unterschiedliche Ansätze konnte die Helligkeit des Systems in Säugerzellen ebenfalls stark erhöht werden, sodass sich einzelne Zellen mit Hilfe eines Biolumineszenz-Mikroskops beobachten lassen.
Biolumineszierende Organismen
Zusätzlich zu in vitro kultivierten Säugerzellen kann das bakterielle Biolumineszenz-System auch verwendet werden, um biolumineszente Eigenschaften in Organismen zu etablieren. Auf diese Weise konnten Mausmodelle entwickelt werden, die während ihrer gesamten Lebensspanne Licht emittieren und somit die Durchführung von Langzeit-Biolumineszenzmessungen ermöglichen.
Weiterführende Informationen
- A. Kiszka, C. Dullin, H. Steffens, T. Koenen, E. Rothermel, F. Alves, C. Gregor (2025):
„Autonomous bioluminescence emission from transgenic mice“
Science Advances 11, eads0463
- T. Brinker, C. Gregor (2024):
„Increased autonomous bioluminescence emission from mammalian cells by enhanced cofactor synthesis“
Chemosensors 12, 223
- C. Gregor (2022):
„Generation of bright autobioluminescent bacteria by chromosomal integration of the improved lux operon ilux2“
Sci. Rep. 12, 19039
- C. Gregor, J. K. Pape, K. C. Gwosch, T. Gilat, S. J. Sahl, S. W. Hell (2019):
„Autonomous bioluminescence imaging of single mammalian cells with the bacterial bioluminescence system“
Proc. Natl. Acad. Sci. U. S. A. 116, 26491 – 26496
- C. Gregor (2018):
„Autonome Lichtproduktion in Bakterien mit optimiertem ilux-Operon“
BIOspektrum 24, 697 – 699
- C. Gregor, K. C. Gwosch, S. J. Sahl, S. W. Hell (2018):
„Strongly enhanced bacterial bioluminescence with the ilux operon for single-cell imaging“
Proc. Natl. Acad. Sci. U. S. A. 115, 962 – 967
Produkte und Dienstleistungen
Auftragsforschung Nanoskopie
- Suchen Sie nach Lösungen für ein lichtmikroskopisches Problem?
- Wünschen Sie sich einen Dienstleister, der Ihr Forschungsbudget kundenorientiert und zuverlässig nach Ihren Wünschen in Lösungen umsetzt?
- Brauchen Sie schnell einen Prototypen, der genau Ihren Anforderungen entspricht?
Unser Team steht Ihnen mit seinen umfangreichen Erfahrungen, Kompetenzen und technischen Möglichkeiten im Bereich der optischen Nanoskopie zur Verfügung. Kein Bereich der Auftragsforschung ist uns fremd.
Typische Aufgaben:
- Beratung zu messtechnischen Fragestellungen
- Erstellung von Machbarkeitsstudien
o Entwicklung einer geeigneten Labellingstrategie
o Bestimmung des für die Anwendung optimalen Nanoskopieverfahrens - Durchführung lokaler Untersuchungskampagnen
- Bereitstellung von Equipment
- Entwicklung von problem- und kundenorientierten Messverfahren
- Prototypentwicklung
Unser Team ist für jede neue Herausforderung bereit.
Kontaktieren Sie uns!
Wir freuen uns darauf, maßgeschneiderte Nanoskopie- und Mikroskopie-Lösungen für Ihre Probleme zu entwickeln.
Ansprechpartner/in:
Abteilungsleiter/in
Apl. Prof. Dr. Alexander Egner
Dr. Claudia Geisler
„Optische Nanoskopie“
Tel.: +49(0)551/5035-35
Fax: +49(0)551/5035-99
alexander.egner@ifnano.de
claudia.geisler@ifnano.de
Ansprechpartnerin für
Biolumineszenz-Bildgebung:
Dr. Carola Gregor
Tel.: +49(0)551/5035-62
Fax: +49(0)551/5035-99
carola.gregor@ifnano.de
Abteilungsmitarbeiter
Abteilungsleiter
E-Mail: alexander.egner@ifnano.de
Tel.: +49 551 5035-35
Doktorand
E-Mail: ayiben.nuerbahati@ifnano.de
Tel.: +49 551 5035-67
Doktorandin
E-Mail: aishwarya.nair@ifnano.de
Tel.: +49 551 5035-57
Mitarbeiter
E-Mail: r.siegmund@ifnano.de
Tel.: +49 551 5035-64
Veröffentlichungen
Publikationen
- C. Gregor, F. Grimm, J. Rehman, C. A. Wurm, A. Egner:
Click chemistry with cell-permeable fluorophores expands the choice of bioorthogonal markers for two-color live-cell STED nanoscopy Cells 13, 683 (2024) - T. Brinker, C. Gregor:
Increased autonomous bioluminescence emission from mammalian cells by enhanced cofactor synthesis, Chemosensors 12, 223 (2024) - I. Gallea, O. Nevskyi, Z. Kaźmierczak, T. Chen, P. Miernikiewicz, A. Chizhik, K. Dąbrowska, M. Bates, J. Enderlein:
Super-resolution going viral: T4 virus particles as perfect nature-designed 3D-Bio-NanoRulers, bioRxiv, doi: 10.1101/2024.04.04.588072 (2024)
Publikationen
- O. Laitenberger, T. Aspelmeier, T. Staudt, C. Geisler, A. Munk, A. Egner:
Towards Unbiased Fluorophore Counting in Superresolution Fluorescence Microscopy, Nanomaterials 13(3), 459 (2023) - P. Jain, C. Geisler, D. Leitz, V. Udachin, S. Nagorny, T. Weingartz, J. Adams, A. Schmidt, C. Rembe, A. Egner:
Super-resolution Reflection Microscopy via Absorbance Modulation, ACS Nanoscience AU 3 (5), 375-380 (2023) - S.V. Schweighofer, D.C. Jans, Jan Keller-Findeisen, A. Folmeg, M. Bates, S. Jakobs:
Endogenous BAX and BAK form mosaic rings of variable size and composition on apoptotic mitochondria (Preprint), bioRxiv (2023), https://doi.org/10.1101/2023.08.18.553869 - S. S. Stoldt, M. Barbot, T.D. Carney, F. Lange, M. Bates, P. Bou Dib, H.R. Shcherbata, M. Meinecke, D. Riedel, S. Dennerlein, P. Rehling, S. Jakobs:
The Drosophila MIC10 orthologue has a propensity to polymerize into cristae-shaping filaments (Preprint), bioRxiv (2023), https://doi.org/10.1101/2023.04.17.537183 - Antolovic, A. Egner, B. Henriques-Normark, I. Rimke, A. Schönle, J. Widengren:
Near-IR Nanoscopy and Vibrational Microscopy, Imaging & Microscopy 2023 (1), 19-21 (2023)
Konferenzbeiträge
- M. Bates:
4Pi-STORM visualization of nuclear pore complex architecture, EMBO Workshop: In situ structural biology: from cryo-EM to multi-scale modelling, EMBL Heidelberg, Heidelberg (02.2023) - M. Bates, L. Reinkensmeier, A. Egner:
Rapid Optimized Drift Correction for Single Molecule Localization Microscopy, Focus on Microscopy 2023, Porto, Portugal (04.2023) - L. Reinkensmeier:
COMET – Cost-function Optimized Maximal overlap drift EsTimation, Single Molecule Localization Microscopy Symposium SMLMS 2023, Wien, Österreich (08.2023) - A. Egner:
Gaining Deeper Insights into the Nanoworld: Surpassing the Limits of Diffraction by Innovative Light Microscopy Technology, Schnelltest-Tagung, Göttingen (09.2023) - M. Bates:
Photo-Switchable Organic Dyes: the Photophysics of SMLM, MIFOBIO Workshop: Functional Microscopy for Biology, Presqui’ile de Giens, France (11.2023) - M. Bates:
Exploring protein complex architecture with STORM microscopy, Cambridge Microscopy Meeting 2023, University of Cambridge, Cambridge, UK (12.2023)
Publikationen
- J. Kratz, C. Geisler, A. Egner:
ISM-assisted tomographic STED microscopy, Optics Express 30(2), 939 – 956 (2022) - M. Bates, J. Keller-Findeisen, A. Przybylski, A. Hüper, T. Stephan, P. Ilgen, A. R. Cereceda Delgado, E. D‘Este, A. Egner, S. Jakobs, S. J. Sahl, S. W. Hell:
Optimal precision and accuracy in 4Pi-STORM using dynamic spline PSF models, Nature Methods 19(5), 603 – 612 (2022) - W. C. Wegner, H. Steffens, C. Gregor, F. Wolf, K. I. Willig:
Environmental enrichment enhances patterning and remodeling of synaptic nanoarchitecture as revealed by STED nanoscopy, eLife 11, e73603 (2022) - C. Gregor:
Generation of bright autobioluminescent bacteria by chromosomal integration of the improved lux operon ilux2, Scientific Reports 12, 19039 (2022)
Konferenzbeiträge
- M. Bates:
Nanometer-scale 3D fluorescence imaging with 4Pi-STORM, Microscopy Club Lecture – Online (03.2022) - M. Bates, J. Keller-Findeisen, A. Przybylski, A. Hüper, T. Stephan, P. Ilgen, A.R. Cereceda Delgado, E. D’Este, A. Egner, S. Jakobs, S.J. Sahl, S.W. Hell:
Optimal Precision and Accuracy in 4Pi-STORM using Dynamic Spline PSF Models, Focus on Microscopy 2022 – Online (04.2022) - C. Gregor:
Autonomous bioluminescence microscopy of bacterial and mammalian cells, 21st International Symposium on Bioluminescence and Chemiluminescence and XIX International Symposium on Luminescence Spectrometry, Gijón, Spanien (06.2022) - M. Bates:
4Pi-STORM studies of Nuclear Pore Complex architecture, Single Molecule Localization Microscopy Symposium 2022, Paris (08.2022) (invited) - D. Ghosh, C. Geisler, A. Egner:
Photon-stream-based aberration correction for STED microscopy, DPG Tagung Regensburg 2022, Regensburg (09.2022)
Buchbeitrag
- C. Gregor:
Imaging of Autonomous Bioluminescence Emission from Single Mammalian Cells, In: Bioluminescence – Methods and Protocols Volume 1, Sung-Bae Kim (eds.), Methods in Molecular Biology 2524, Springer US (2022), ISBN: 978-1-0716-2452-4 (Hbk); 978-1-0716-2453-1 (pdf)
Publikationen
- K. Soliman, F. Grimm, C. A. Wurm, A. Egner:
Predicting the membrane permeability of organic fluorescent probes by the deep neural network based lipophilicity descriptor DeepFl‑LogP, Scientific Reports 11(1), 6991 (2021) - R. Siegmund, F. Werner, S. Jakobs, C. Geisler, A. Egner:
isoSTED microscopy with water-immersion lenses and background reduction, Biophysical Journal 120, 1 – 12 (2021)
Konferenzbeiträge
- J. Kratz, C. Geisler, A. Egner:
ISM-Assisted Tomographic STED Microscopy Allows for Sample-Gentle Super-Resolution Imaging,
65th Biophysical Society Annual Meeting 2021, virtual (02.2021) - J. Kratz, C. Geisler, A. Egner:
ISM-Assisted Tomographic STED Microscopy Allows for Sample-Gentle Super-Resolution Imaging,
Focus on Microscopy 2021, virtual (03.2021) - P. Jain, V. Udachin, S. Nagorny, C. Geisler, J. Adams, A. Schmidt, C. Rembe, A. Egner:
High resolution reflection microscopy via absorbance modulation, Microscience Microscopy Congress 2021, virtual, (07.2021) - C. Gregor:
Autonomous bioluminescence imaging of single cells, 16th Annual Meeting of the European Society for Molecular Imaging – EMIM 2021, Göttingen (08.2021) - C. Gregor:
Autonomous bioluminescence microscopy of bacterial and mammalian cells, 21st International Symposium on Bioluminescence and Chemiluminescence and XIX International Symposium on Luminescence Spectrometry, Gijón, Spanien (06.2022)
Publikationen
- T. Staudt, T. Aspelmeier, O. Laitenberger, C. Geisler, A. Egner, A. Munk:
Statistical Molecule Counting in Super-Resolution Fluorescence Microscopy: Towards Quantitative Nanoscopy, Statistical Sciences 35 (1), 92 – 111 (2020) - B. Vinçon, C. Geisler, A. Egner:
Pixel hopping enables fast STED nanoscopy at low light dose, Optics Express 28 (4), 4516 – 4528 (2020) - J.-R. Krüger, J. Keller-Findeisen, C. Geisler, A. Egner:
Tomographic STED microscopy, Biomedical Optics Express 11(6), 3139 – 3163 (2020)
Buchbeiträge
- A. Egner, C. Geisler, R. Siegmund:
STED nanoscopy, In: Nanoscale Photonic Imaging, T. Salditt et al. (eds.), Topics in Applied Physics 134, Springer International Publishing (2020)
Konferenzbeiträge
- B. Vinçon, C. Geisler, A. Egner:
Ultrafast Switchable Depletion Patterns for tomoSTED Microscopy Generated by Conical Diffraction, Focus on Microscopy 2019, London, Großbritannien (04.2019) - A. Egner:
isoSTED microscopy in living cells, International Symposium on Nanoscale Photonic Imaging, Venedig, Italien (03.2019) - A. Egner:
Quantitative Microscopy, Cluster of Excellence (EXC 171) & DFG Research Center (FZT 103) – CNMPB Final Symposium, Göttingen (08.2019) - C. Geisler:
Optical Nanoscopy: Imaging beyond the diffraction limit, CINSat Autum Colloquium 2019, Universität Kassel, Kassel (10.2019) - C. Geisler, R. Kowarsch, P. Jain, C. Rembe, A. Egner:
Hochauflösende Reflexionsmikroskopie mittels Absorptionsmodulation, – Photonic Net – Forum MikroskopieTrends ’19, Göttingen (12.2019)
Publikationen
- R. Kowarsch, C. Geisler, A. Egner, C. Rembe:
Superresolution reflection microscopy via absorbance modulation: A theoretical study,
Opt. Ex. 26 (5) (2018)
- B. Roubinet, M. Bischoff, S. Nizamov, S. Yan, C. Geisler, S. Stoldt, G. Y. Mitronova, V. N. Belov,
M. L. Bossi, S. W. Hell:
Photoactivatable Rhodamine Spiroamides and Diazoketones Decorated with “Universal Hydrophilizer” or Hydroxyl Groups, J. Org. Chem. 83, 12 (2018)
- E. Neubert, D. Meyer, F. Rocca, G. Günay, J. Grandke, A. Kwaczala-Tessmann, S. Senger-Sander, C. Geisler, A. Egner, M. Schön, L. Erpenbeck, S. Kruss:
Chromatin swelling drives neutrophil extracellular trap release, Nature Communications 9,1:3767 (2018)
Konferenzbeiträge
- A. Egner:
Lichtblicke in die Nanowelt – Neue Methoden der Lichtmikroskopie überlisten die Beugung, Saturday Morning Lecture, Universität Hannover (01.2018) - K. Soliman, F. Rocca, R. Siegmund, C. Geisler, A. Egner:
STED nanoscopy: imaging beyond the diffraction limit of light, 23rd Dubai International Pharmaceuticals and Technologies Conference and Exhibition DUPHAT 2018, Dubai (02.2018)J.-R. Krüger, B. Vinçon, C. Geisler, A. Egner:
Overcoming the resolution barrier by STED microscopy, SPIE Optics + Photonics, Nanoscience + Engineering, Nanoimaging and Nanospectroscopy VI, San Diego, CA, USA (08.2018) - D. Köhne, C. Geisler, P. Simon, A. Egner:Novel STED-assisted nanostructuring method for subtractive sub-diffraction writing, SPIE Optics + Photonics, Nanoscience + Engineering, Nanoimaging and Nanospectroscopy VI, San Diego, CA, USA (08.2018)
- R. Kowarsch, C. Geisler, A. Egner, C. Rembe:
Modeling superresolution reflection microscopy via absorbance modulation, SPIE Optics + Photonics, Nanoscience + Engineering, Nanoimaging and Nanospectroscopy VI, San Diego, CA, USA (08.2018) - A. Egner:
Subdiffraction-resolution fluorescence imaging, SFB 1286 Symposium ‘Advanced microscopy & biomedicine meets NanoSIMS’, Göttingen (10.2018)
Konferenzbeiträge
- R. Siegmund, C. Geisler, A. Egner:
IsoSTED microscopy in living cells, SFB 755 Winterschool 2017,
Hirschegg Kleinwalsertal, Österreich, (02.2017)
- J.-R. Krüger, J. Keller-Findeisen, C. Geisler, A. Egner:
Tomographic STED microsopy, CNMPB-Retreat,
Bad Sooden-Allendorf (02.2017)
- F. Rocca, N. Mazkereth, J. Krüger, C. Geisler, A. Egner, Z. Fishelson:
Two-Color STED microscope for the analysis of stress-induced interaction between
mitochondrial chaperone mortalin and the plasma membrane attack complex,
Focus on Microscopy 2017, Bordeaux, France (04.2017)
- J. Krüger, J. Keller-Findeisen, B. Vincon, C. Geisler, A. Egner:
Tomographic STED microscopy, Focus on Microscopy 2017,
Bordeaux, France (04.2017)
- H. Mittelstädt, C. Geisler, A. Egner:
Single marker switching microscope with isotropic resolution over large axial range,
SPIE Optics + Photonics, Nanoscience + Engineering, Nanoimaging and Nanospectroscopy V,
San Diego, CA, USA (08.2017) - J.-R. Krüger, J. Keller-Findeisen, C. Geisler, A. Egner:
Tomographic STED microscopy,
SPIE Optics + Photonics, Nanoscience + Engineering,
Nanoimaging and Nanospectroscopy V, San Diego, CA, USA (08.2017) - A. Egner:
Optical nanoscopy: Decoding the building blocks of life beyond the diffraction barrier, XXXI. AHMT Symposium 2017, Clausthal-Zellerfeld (09.2017) - A. Egner:
Optical nanoscopy and statistics: Towards the optimum resolution, Statistics Meets Friends – from biophysics to inverse problems and back, Göttingen (11.2017) - A. Egner:
Tomographic STED Microscopy, Forum MikroskopieTrends ´17, Göttingen (12.2017)
Publikationen
- A. Gucek, J. Jorgacevski, P. Singh, C. Geisler, M. Lisjak, N. Vardjan, M. Kreft, A. Egner, R. Zorec:
„Dominant negative SNARE peptides stabilize the fusion pore in a narrow, release-unproductive state“, Cell. Mol. Life Sci. (2016).
- S. J. Sahl, F. Balzarotti, J. Keller-Findeisen, M. Leutenegger, V. Westphal, A. Egner, F. Lavoie-Cardinal, A. Chmyrov, T. Grotjohann, S. Jakobs:
„Comment on „extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics“. Science 352 (6285), 527-527, (2016)
- N. Mazkereth, F. Rocca, J. Schubert, C. Geisler, Y. Hillman, A. Egner, Z. Fishelson:
„Complement triggers relocation of Mortalin/GRP75 frommitochondria to the plasma membrane”, Immunobiology, (2016)
Konferenzbeiträge
- H. Grefe, C. Geisler, A. Egner:
Novel 3D single marker switching microscope with isotropic resolution over large axial range,
SPIE Photonics West 2016, Single Molecule Spectroscopy and Superresolution Imaging IX,
San Francisco, USA (02.2016)
- A. Egner:
New developments in optical nanoscopy, International Symposium 2016 „Biological Dynamics from Microscopic to Mesoscopic Scales“, Grimma (02.2016)
- R. Siegmund, C. Geisler, A. Egner:
isoSTED microscopy in living cells, International Symposium 2016 „Biological Dynamics from Microscopic to Mesoscopic Scales“, Grimma (02.2016)
- H. Mittelstädt, C. Geisler, A. Egner:
Single Marker Switching Microscope with Isotropic Resolution over Large Axial Range, Focus on Microscopy 2016, Taipei, Taiwan (03.2016)
- J. Schubert, J. Keller-Findeisen, C. Geisler, B. Vincon, A. Egner:
Low-intensity STED microscope with increased image brightness and uncompromised resolution,
80. Jahrestagung der DPG und DPG-Frühjahrstagung, Regensburg (03.2016)
- A. Egner:
Super-resolved fluorescence microscopy: Principle and applications of STED microscopy, BioImaging Symposium 2016, München (04.2016)
- D. Köhne, C. Geisler, P. Simon, A. Egner:
Principles and applications of optical switching assisted imaging and structuring schemes, International Conference on Physics 2016, New Orleans, USA (06.2016)
- A. Egner, J. Schubert, C. Geisler, B. Vincon:
Low-intensity STED microscope with increased image brightness and uncompromised resolution,
SPIE Nanoscience + Engineering, Nanoimaging and Nanospectroscopy IV,
San Diego, USA (08.2016)
- A. Egner:
Super-resolved fluorescence microscopy: Principle and applications of STED microscopy,
623th Wilhelm and Else Heraeus-Seminar on „Cellular Dynamics“, Bad Honnef (09.2016)
- R. Siegmund, F. Rocca, C. Geisler, A. Egner:
isoSTED microscopy in living cells, International Symposium 2016 „Biological Dynamics from Microscopic to Mesoscopic Scales“, Grimma (02.2016)
- A. Egner, A. Munk:
Statistical reconstruction methods for time varying nanoscale imaging problems,
International Symposium 2016 „Biological Dynamics from Microscopic to Mesoscopic Scales“,
Grimma (02.2016)
- B. Vinçon, J.-R. Krüger, C. Geisler, A. Egner:
Ultrafast switchable depletion patterns for STED microscopy generated by conical diffraction, 623th Wilhelm and Else Heraeus-Seminar on „Cellular Dynamics“, Bad Honnef (09.2016)
- F. Rocca, N. Mazkereth, J.-R. Krüger, C. Geisler, A. Egner, Z. Fishelson:
Complement triggers relocation of Mortalin/GRP75 from mitochondria to the plasma membrane, 623th Wilhelm and Else Heraeus-Seminar on „Cellular Dynamics“, Bad Honnef (09.2016)
Publikationen
- A. Hartmann, S. Huckemann, J. Dannemann, O. Laitenberger, C. Geisler, A. Egner, A. Munk:
Drift Estimation in sparse sequential dynamic imaging: with application to nanoscale fluorescence microscopy, J. R. Stat. Soc. B, doi: 10.1111/rssb.12128 (2015)
- T. Aspelmeier, A. Egner, A. Munk:
Modern Statistical Challenges in High-Resolution Fluorescence Microscopy, Annu. Rev. Stat. Appl. 2, 163–202 (2015)
Konferenzbeiträge
- R. Siegmund, C. Geisler, F. Rocca, C. A. Wurm, S. Jakobs, A. Egner:
Three Dimensional IsoSTED Microscopy In Living Cells, Focus on Microscopy 2015, Göttingen (03.2015)
- O. Laitenberger, A. Hartmann, C. Geisler, A. Munk, A. Egner:
Statistical Drift Estimation And Correction Methods For Single Marker Switching Based Microscopy, Focus on Microscopy 2015, Göttingen (03.2015)
- H. Grefe, C. Geisler, A. Egner:
Novel 3D Single Marker Switching Microscope With Isotropic Resolution Over Large Axial Range, Focus on Microscopy 2015, Göttingen (03.2015)
- A. Egner, C. Geisler, H. Grefe, J. Schubert:
Developments in fluorescence nanoscopy, Optics + Photonics, Nanoimaging and Nanospectroscopy III, San Diego (08.2015)
- R. Siegmund, C. Geisler, A. Egner:
isoSTED microscopy in living cells, Optics + Photonics, Nanoimaging and Nanospectroscopy III, San Diego (08.2015)
- A. Egner:
Super-Resolved Fluorescence Microscopy: Principle and Applications of STED Microscopy, IMB seminar, Tromsø (10.2015)
- A. Egner:
Angewandte Optik – abbilden, analysieren und strukturieren mit Licht, Bier & Brezeln, Göttingen (11.2015)
- J.-R. Schubert, C. Geisler, A. Egner:
Low-Intensity STED Microscope With Increased Image Brightness And Uncompromised Resolution, Focus on Microscopy 2015, Göttingen (03.2015)
Publikationen
- A. Hartmann, S. Huckemann, J. Dannemann, O. Laitenberger, C. Geisler, A. Egner, A. Munk:
Drift Estimation in sparse sequential dynamic imaging: with application to nanoscale fluorescence microscopy arxiv.org, 1403.1389, (2014) - V. N. Belov, G. Y. Mitronova, M. L. Bossi, V. P. Boyarskiy, E. Hebisch, C. Geisler, K. Kolmakov, C. A. Wurm, K. I. Willig, S. W. Hell:
Masked Rhodamine Dyes of Five Principal Colors Revealed by Photolysis of a 2-Diazo-1-Indanone Caging Group: Synthesis, Photophysics, and Light Microscopy Applications, Chem. Eur. J. 20, 13162-13173 (2014)
Konferenzbeiträge
- A. Egner:
Overcoming the resolution barrier by STED microscopy Symposium on Advanced Microscopy Techniques in Life Sciences, Homburg (04.2014)
- A. Egner:
Three‐dimensional optical nanoscopy with opposing lenses SPIE Optics and Photonics, San Diego (08.2014)
- A. Egner:
Three‐dimensional optical nanoscopy with opposing lenses 18th International Microscopy Congress, Prague (09.2014)
- A. Egner:
Optical Nanoscopy meets Statistiks: Decoding the Building Blocks of Life Eröffnungssymposium des Felix‐Bernstein Institut für Mathematische Statistik in den Biowissenschaften, Göttingen, (10.2014)
Konferenzbeiträge
- A. Egner:“Three-dimensional optical nanoscopy with opposing lenses“Symposium on
„Super Resolution Imaging“, Göttingen (2013) - C. Geisler, R. Schmidt, D. Aquino, S. W. Hell, A. Egner:
„Developments in Fluorescence Nanoscopy“
SPIE Optics + Photonics, San Diego (2013) - C. Geisler, T. Hotz, A. Schönle, S. W. Hell, A. Munk, A. Egner:
„Drift estimation for single marker switching based imaging schemes“
SPIE Optics + Photonics, San Diego (2013) - A. Egner:
„Superresolution Microscopy“
Fourth Annual Conference „Superresolution Microscopy“, Ljubljana (2013) - C. Geisler, J. Jorgačevski, M. Kreft, R. Zorec, A. Egner:
„Two-color STED microscopy“
Fourth Annual Conference „Superresolution Microscopy“, Ljubljana (2013) - A. Egner:
„Overcoming the resolution barrier by STED microscopy“
Visualizing the invisible in cell biology, Symposium on super-resolution microscopy, Prague (2013)
Publikationen
- C. Geisler, T. Hotz, A. Schönle, S. W. Hell, A. Munk, A. Egner:
„Drift estimation for single marker switching based imaging schemes“
Opt. Express 20, 7274 (2012) - F. Opazo, M. Levy, M. Byrom, C. Schäfer, C. Geisler, T. W. Groemer, A. D. Ellington, S. O. Rizzoli:
„Aptamers as potential tools for superresolution microscopy“
Nat. Meth. 9, 938 (2012) - A. C. Meyer, D. Khimich, A. Egner, T. Moser:
„Super-resolution optical microscopy of the organ of Corti.
Investigations on the fine structure of the inner hair cell afferent synapse by the 4Pi and STED techniques.“
HNO 60, 707 (2012) - G. Whelan, E. Kreidl, G. Wutz, A. Egner, J. M. Peters, G. Eichele:
„Cohesin acetyltransferase Esco2 is a cell viability factor and is required for cohesion in pericentric heterochromatin.“
EMBO J. 31, 71 (2012)
Konferenzbeiträge
- A. Egner:
Superresolution Microscopy, Jahrestagung der Deutschen Gesellschaft für experimentelle und klinische Pharmakologie.
Dresden (03.2012) - J. Ihlemann, C. Geisler, R. Schmidt, D. Aquino, S. W. Hell, A. Egner:
Developments in Fluorescence Nanoscopy. 14th International Congress of Histochemistry and Cytochemistry, Kyoto (08.2012)
Publikationen
- D. Aquino, A. Schönle, C. Geisler, C. v. Middendorff, C. A. Wurm, Y. Okamura, T. Lang, S. W. Hell, A. Egner:
„Two-color nanoscopy of three-dimensional volumes by 4Pi detection of stochastically switched fluorophores“. Nature Methods, 8 (4), 353 – 359, (2011) - Y. Okamura, R. Schmidt, I. Raschke, M. Hintze, S. Takeoka, A. Egner, T. Lang:
„A Few Immobilized Thrombins Are Sufficient for Platelet Spreading“
Biophysical Journal, Volume 100, Issue 8, (2011) - Y. Hua, R. Sinha, C. Thiel, R. Schmidt, J. Huve, H. Martens, S. W. Hell, A. Egner, J. Klingauf:
„A readily retrievable pool of synaptic vesicles“, Nature Neuroscience, doi:10.1038/nn.2838, (2011) - C. A. Wurm, D. Neumann, M. A. Lauterbach, B. Harke, A. Egner, S. W. Hell, S. Jakobs:
„Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient“
PNAS, doi:10.1073/pnas.1107553108, (2011) - K. Kumar, L. Isa, A. Egner, R. Schmidt, M. Textor, E. Reimhult:
„Formation of Nanopore-Spanning Lipid Bilayers through Liposome Fusion!“Langmuir, 27, 10920-10928, (2011) - C. K. Ullal, S. Primpke, R. Schmidt, U. Böhm, A. Egner, P. Vana, S. W. Hell:
„Flexible Microdomain Specific Staining of Block Copolymers for 3D Optical Nanoscopy“
Macromolecules, 44, 7508-7510, (2011)
Konferenzbeiträge:
- Egner A.:
Diffraction-unlimited 3D optical microscopy with opposing lenses, Photonics West, San Francisco, (01.2011) - Egner A.:
isoSTED & 4Pi-SMS microscopy, Focus on Microscopy, Konstanz, (04.2011) - Egner A.:
Optical switching and time-sequential coherent detection of markers through opposing lenses enables multicolor 3D-nanoscopy with 10-nm resolution of large intracellular volumes, European Conference on Biomedical Optics, München, (05.2011)
Publikationen
- A. Kiszka, C. Dullin, H. Steffens, T. Koenen, E. Rothermel, F. Alves, C. Gregor:
Autonomous bioluminescence emission from transgenic mice, Science Advances 11, eads0463 (2025) - C. V. Srambickal, H. M. Esmaeeli, J. Piguet, L. Reinkensmeier, R. Siegmund, A. Agostinho, M. Bates, A. Egner, J. Widengren:
Near-infrared MINFLUX imaging enabled by suppression of fluorophore blinking, Science Advances 11(49), eadw3149 (2025) - L. Reinkensmeier, R. Siegmund, M. Bates, G. Stibenz, P. Trabs, S. Popien, I. Rimke, S. Heuke, A. Egner:
Novel Laser Technology Enables 10x Faster SRS Imaging and Rapid Tuning in Biological Samples, bioRxiv, doi: 10.1101/2025.01.31.635524 (2025) - J. I. Gallea, O. Nevskyi, Z. Kaźmierczak, I. Gligonov, T. Chen, P. Miernikiewicz, A. M. Chizhik, L. Reinkensmeier, K. Dąbrowska, M. Bates, J. Enderlein:
Super-Resolution Goes Viral: T4 Virus Particles as Versatile 3D-Bio-NanoRulers, Advanced Materials 37(12), 2403365 (2025) - I. Rimke, L. Reinkensmeier, R. Siegmund, G. Stibenz, P. Trabs, S. Popien, C. Canela, X. Gao, W. Min, A. Egner:
Fast and ultrasensitive multispectral SRS imaging with new light source, in European Conferences on Biomedical Optics 2025, Technical Digest Series (Optica Publishing Group), paper W3A.29 (2025)
Konferenzbeiträge
- N. Ayiben, R. Siegmund, A. Egner:
Background Noise and PSF Characterization for high reflecting sample in PS-SS-OCT Using the Movement of Mirror on Reference Arm, European Conference on Biomedical Optics 2025, München (06.2025) - I. Rimke, L. Reinkensmeier, R. Siegmund, G. Stibenz, P. Trabs, S. Popien, C. Canela, X. Gao, W. Min, A. Egner:
Fast and ultrasensitive multispectral SRS imaging with new light source, European Conference on Biomedical Optics 2025, München (06.2025) - J. Zhang, P. Jain, C. Geisler, S. Nagorny, T. Weingartz, A. Eitzeroth, A. Egner, C. Rembe:
1D Line-Scan Imaging of Gold Nanoparticles beyond Diffraction Limit with White Light via Absorbance Modulation Nanoscopy, Optical Measurement Systems for Industrial Inspection XIV, part of SPIE Optical Metrology, München (06.2025) - A. Egner: Pushing the Limits: Innovations in Super-Resolution Fluorescence Microscopy, Göttingen Expansion Microscopy Forum 2025, Göttingen (09.2025)
Publikationen
- G. Vicidomini, R. Schmidt, A. Egner, S. W. Hell, A. Schönle:
„Automatic deconvolution in 4Pi-microscopy with variable phase“
Opt. Exp. 18 (8), 10154 – 10167, (2010) - C. A. Wurm, D. Neumann, R. Schmidt, A. Egner and S. Jakobs:
„Sample Preparation for STED Microscopy“
In: D.B. Papkovsky (ed.), Live Cell Imaging, Methods in Molecular Biology 591, DOI 10.1007/978-1-60761-404-3 11, © Humana Press, a part of Springer Science+Business Media,
LLC (2010) - T. Frank, M. A. Rutherford, N. Strenzke, A. Neef, T. Pangrsic, D. Khimich, A. Fejtova, E. D. Gundelfinger, M. C. Liberman, B. Harke, K. E. Bryan, A. Lee, A. Egner, D. Riedel, T. Moser:
„Bassoon and the Synaptic Ribbon Organize Ca2+ Channels and Vesicles to Add Release Sites and Promote Refilling“
Neuron, 68, 724-738, (2010)
Publikationen
- S. W. Hell, R. Schmidt, A. Egner:
„Diffraction-unlimited three-dimensional optical nanoscopy with opposing lenses“ (Nature Photonics 3, 381 – 387), (2009) - A. C. Meyer, T. Frank, D. Khimich, G. Hoch, D. Riedel, N. M. Chapochnikov, Y. M. Yarin, B. Harke, S. W. Hell,
A. Egner, T. Moser:
„Tuning of synapse number, structure and function in the cochlea“, Nature Neuroscience 12 (4), 444-453, (2009) - R. Schmidt, C. A. Wurm, A. Punge, A. Egner, S. Jakobs, S. W. Hell:
„Mitochondrial Cristae Revealed with Focused Light“, Nano Lett. 9 (6), 2508-2510, (2009) - C. K. Ullal, R. Schmidt, S. W. Hell, A. Egner:
„Block Copolymer Nanostructures Mapped by Far-Field Optics“, Nano Lett. 9 (6), 2497-2500 (2009) - G. Perinetti, T. Müller, A. Spaar, R. Polishchuk, A. Luini, A. Egner:
„Correlation of 4Pi and Electron Microscopy to Study Transport Through Single Golgi Stacks in Living Cells with Super Resolution“, Traffic 10, 379-391, (2009)
- R. Schmidt, C. A. Wurm, S. Jakobs, J. Engelhardt, A. Egner, S. W. Hell:
„Spherical nanosized focal spot unravels the interior of cells“
Nature Meth. 5 (6), 539 – 544 (2008) - M. Andresen, A. C. Stiel, J. Fölling, D. Wenzel, A. Schönle, A. Egner, C. Eggeling, S. W. Hell, S. Jakobs:
„Photoswitchable fluorescent proteins enable monochromatic multilabel imaging and dual color fluorescence nanoscopy“
Nature Biotech. 26 (9), 1035-1040 (2008) - A. C. Stiel, M. Andresen, H. Bock, M. Hilbert, J. Schilde, A. Schönle, C. Eggeling, A. Egner, S. W. Hell, S. Jakobs:
„Generation of Monomeric Reversibly Switchable Red Fluorescent Proteins for Far-Field Fluorescence Nanoscopy“
Biophys. J. 95, 2989-2997 (2008) - M. Bossi, J. Fölling, V. N. Belov, V. P. Boyarskiy, R. Medda, A. Egner, C. Eggeling, A. Schönle, S. W. Hell:
„Multicolor Far-Field Fluorescence Nanoscopy through Isolated Detection of Distinct Molecular Species“
Nano Letters 8 (8), 2463 – 2468 (2008) - C. v. Middendorff, A. Egner, C. Geisler, S. W. Hell, A. Schönle:
„Isotropic 3D Nanoscopy based on single emitter switching“
Opt. Expr. 16 (25), 20774-20788 (2008) - I. Testa, A. Schönle, C. v. Middendorff, C. Geisler, R. Medda, C. A. Wurm, A. C. Stiel, S. Jakobs, M. Bossi, C. Eggeling, S. W. Hell, A. Egner:
„Nanoscale separation of molecular species based on their rotational mobility“
Opt. Expr. 16 (25), 21093 – 21104 (2008) - J. Fölling, V. Belov, D. Riedel, A. Schönle, A. Egner, C. Eggeling, M. Bossi, S. W. Hell:
„Fluorescence Nanoscopy with Optical Sectioning by Two-Photon Induced Molecular Switching using Continuous-Wave Lasers“
ChemPhysChem 9, 321 – 326 (2008)
- A. Egner, C. Geisler, C. von Middendorff, H. Bock, D. Wenzel, R. Medda, M. Andresen, A. C. Stiel, S. Jakobs, C. Eggeling, A. Schönle, S. W. Hell:
„Fluorescence nanoscopy in whole cells by asynchronous localization of photoswitching emitters“, Biophys. J. 93, 3285 – 3290 (2007) - J. Fölling, V. Belov, R. Kunetsky, R. Medda, A. Schönle, A. Egner, C. Eggeling, M. Bossi, S. W. Hell:
„Photochromic Rhodamines provide Nanoscopy with Optical Sectioning“
Angew. Chem. Int. Ed. 46, 6266 – 6270 (2007) - H. Bock, C. Geisler, C. Wurm, S. Jakobs, A. Schönle, A. Egner, S.W. Hell, C. Eggeling:
„Two-color far-field fluorescence nanoscopy based on photoswitching emitters“, Appl. Phys. B 88, 161-165 (2007) - C. Geisler, A. Schönle, C. von Middendorf, H. Bock, C. Eggeling, A. Egner, S.W. Hell:
„Resolution of Lambda /10 in fluorescence microscopy using fast single molecule photo-switching“, Appl. Phys. A 88, 223-226 (2007) - C. Eggeling, M. Hilbert, H. Bock, C. Ringemann, M. Hofmann, A. C. Stiel, M. Andresen, S. Jakobs, A. Egner, A. Schönle, S. W. Hell:
„Reversible Photoswitching Enables Single-Molecule Fluorescence Fluctuation Spectroscopy at High Molecular Concentration“
Micr. Res. Techn. 70, 1003 – 1009 (2007)
- A. Egner, S. W. Hell:
„Fluorescence microscopy with super-resolved optical sections“
Trends Cell Biol. 15 (4): 207 – 215 (2005) - A. Egner, S. Verrier, A. Goroshkov, H.-D. Söling and S. W. Hell:
„4Pi-microscopy of the Golgi apparatus in live mammalian cells“
J. Struct. Biol. 147(1): 70-76 (2004) - S. Jakobs, N. Martini, A. C. Schauss, A. Egner, B. Westermann, S. W. Hell:
„Spatial and temporal dynamics of budding yeast mitochondria lacking division component Fis1p“
J. Cell Sci. 116: 2005-2014 (2003) - A. Egner, S. Jakobs and S. W. Hell:
„Fast 100-nm resolution 3D-microscope reveals structural plasticity of mitochondria in live yeast“
Proc. Natl. Acad. Sci. USA 99: 3370-3375 (2002) - A. Egner, V. Andresen, S. W. Hell:
„Comparison of the axial resolution of practical Nipkow-disk confocal fluorescence microscopy with that of multifocal multiphoton microscopy: theory and experiment“
J. Microsc. 206: 24-32 (2003) - V. Andresen, A. Egner, S. W. Hell:
„Time-multiplexed multifocal multiphoton microscope“
Opt. Lett. 26(2): 75-77 (2003) - A. Egner and S. W. Hell:
„Time multiplexing and parallelization in multifocal multiphoton microscopy“
J. Opt. Soc. Am. A 17(7): 1192-1201 (2003) - T. Klar, S. Jakobs, M. Dyba, A. Egner, S. W. Hell:
„Fluorescence microscopy with diffraction resolution limit broken by stimulated emission“
PNAS 97(15): 8206-8210 (2000) - A. Egner, S. W. Hell:
„Equivalence of the Huygens-Fresnel and Debye approach for the calculation of high aperture point-spread-functions in the presence of refractive index mismatch“
J. Microsc. 193(3): 244-249 (1999) - A. Egner, M. Schrader, S. W. Hell:
„Refractive index mismatch induced intensity and phase variations in fluorescence confocal, multiphoton and 4Pi-microscopy“
Opt. Commun. 153: 211-217 (1998)